H2O(l) ←⎯⎯⎯⎯→ H+(aq) + OH–(aq)
- Harga tetapan air adalah:

- Konsentrasi H2O yang terionisasi menjadi H+ dan OH– sangat kecil dibandingkan dengan konsentrasi H2O mula-mula, sehingga konsentrasi H2O dapat dianggap tetap, maka harga K[H2O] juga tetap, yang disebut tetapan kesetimbangan air atau ditulis Kw.
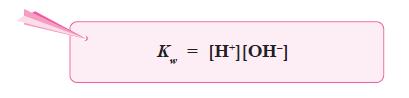
- Pada suhu 25 °C, Kw yang didapat dari percobaan adalah 1,0 × 10–14.
- Harga Kw ini tergantung pada suhu, tetapi untuk percobaan yang suhunya tidak terlalu menyimpang jauh dari 25 °C, harga Kw itu dapat dianggap tetap.
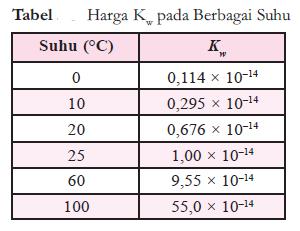
- Harga Kw pada berbagai suhu dapat dilihat pada tabel berikut.



Kekuatan asam dipengaruhi oleh banyaknya ion – ion H+ yang dihasilkan
oleh senyawa asam dalam larutannya. Berdasarkan banyak sedikitnya ion H+
yang dihasilkan, larutan asam dibedakan menjadi dua macam sebagai berikut.
1. Asam Kuat
Asam kuat yaitu senyawa asam yang dalam larutannya terion seluruhnya
menjadi ion-ionnya. Reaksi ionisasi asam kuat merupakan reaksi
berkesudahan. Secara umum, ionisasi asam kuat dirumuskan sebagai berikut.
HA(aq) ⎯⎯→ H+(aq) + A–(aq)

2. Asam Lemah
Asam lemah yaitu senyawa asam yang dalam larutannya hanya sedikit
terionisasi menjadi ion-ionnya. Reaksi ionisasi asam lemah merupakan reaksi
kesetimbangan.
Secara umum, ionisasi asam lemah valensi satu dapat dirumuskan
sebagai berikut.
HA(aq) ←⎯⎯⎯⎯→ H+(aq) + A–(aq)
Makin kuat asam maka reaksi kesetimbangan asam makin condong ke
kanan, akibatnya Ka bertambah besar. Oleh karena itu, harga Ka merupakan
ukuran kekuatan asam, makin besar Ka makin kuat asam.
Berdasarkan persamaan di atas, karena pada asam lemah [H+] = [A–],
maka persamaan di atas dapat diubah menjadi:

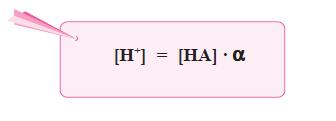


- Kekuatan basa dipengaruhi oleh banyaknya ion – ion OH– yang dihasilkan oleh senyawa basa dalam larutannya.
- Berdasarkan banyak sedikitnya ion OH yang dihasilkan, larutan basa juga dibedakan menjadi dua macam sebagai berikut.
- Basa kuat yaitu senyawa basa yang dalam larutannya terion seluruhnya menjadi ion-ionnya. Reaksi ionisasi basa kuat merupakan reaksi berkesudahan.
- Secara umum, ionisasi basa kuat dirumuskan sebagai berikut.
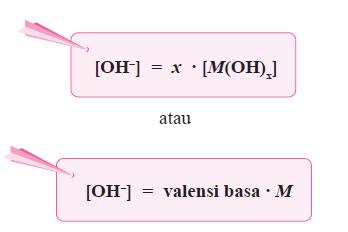
dengan: x = valensi basa
M = konsentrasi basa
2. Basa Lemah
- Basa lemah yaitu senyawa basa yang dalam larutannya hanya sedikit terionisasi menjadi ion-ionnya.
- Reaksi ionisasi basa lemah juga merupakan reaksi kesetimbangan.
- Secara umum, ionisasi basa lemah valensi satu dapat dirumuskan sebagai berikut.
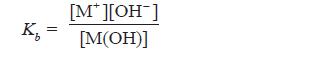
- Makin kuat basa maka reaksi kesetimbangan basa makin condong ke kanan, akibatnya Kb bertambah besar.
- Oleh karena itu, harga Kb merupakan ukuran kekuatan basa, makin besar Kb makin kuat basa.
- Berdasarkan persamaan di atas, karena pada basa lemah [M+] = [OH–], maka persamaan di atas dapat diubah menjadi:

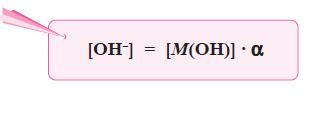


No comments:
Post a Comment